生命科学与技术学院王冕/高绍荣/李婉露团队合作开发可注射多孔微凝胶突破卒中干细胞治疗瓶颈,成果发表于《自然·通讯》
来源:生命科学与技术学院 时间:2025-10-24 浏览:
卒中是全球死亡和致残的主要原因之一,其中缺血性卒中占比高达87%。在缺血性卒中治疗中,干细胞疗法因其在卒中后促进神经恢复的潜力以及治疗时间窗口限制少等优点备受关注。已有临床前研究表明,神经祖细胞(NPCs)移植后可以通过分化替代损伤细胞、分泌保护因子等来促进神经功能恢复。然而,NPCs移植后的在体内的存活和整合仍在存在很大的问题。为了解决这些挑战,结合生物材料的局部递送策略成为了一种潜在的解决方案。其中,可注射微凝胶支架已被证明有利于细胞浸润和组织重塑,并促进血管生成。然而,传统微凝胶缺乏足够的内部空间来支持细胞的存活和增殖,导致细胞负载率低,限制了长期修复效果。因此,开发具备优化细胞负载与存活能力的新型微凝胶支架对于推动干细胞疗法具有重要意义。
近日,同济大学生命科学与技术学院高绍荣院士团队王冕研究员与上海交通大学李婉露教授团队在《自然·通讯》(Nature Communications)期刊上合作发表题为“Injectable Micropore-forming Microgel Scaffold for Neural Progenitor Cells Transplantation and Vascularization after Stroke”的研究论文。该研究开发了一种相分离微孔微凝胶(PSMM)-基质复合支架,可用于高效递送神经祖细胞(NPCs),能够通过促进血管生成和细胞存活,显著改善卒中大鼠的神经功能恢复。

研究团队首先使用双水相体系(海藻酸钠/聚乙烯醇)结合气体剪切微流控的方式高通量制备了大小可控且具有微米级孔隙的微凝胶。实验结果显示,相较于纳米级孔隙微凝胶(MM),微米级孔隙(PSMM)能显著提升NPCs的密度、分布均匀性及活性,从而提高细胞负载能力。
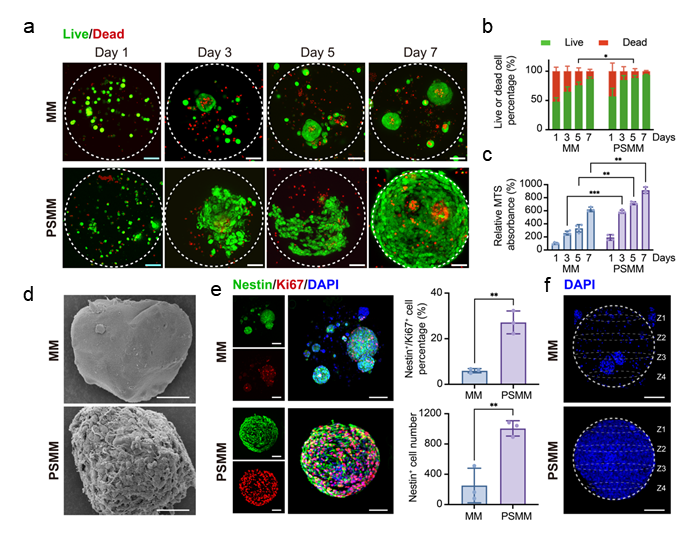
图1. PSMM促进NPCs的体外长期存活
为了提高微凝胶的可注射性和与受损部位的整合能力,研究人员在微凝胶支架内引入了Matrigel/Collagen I (M/C)作为基质。M/C的引入不仅提升了可注射性,保证了细胞在注射过程中的活性,还显著增强了支架的促血管生成作用。HUVEC/MSC体外共培养实验表明,PSMM支架的血管长度为MM组的1.48倍,显示出更优越的血管化效果(图2)。同时HUEVC和HEF的混合培养也证明了两种微凝胶组的血管化面积都显著增加,但PSMM支架显示出更优的血管化效果。结合微凝胶支架孔隙统计结果(PSMM组微小孔隙占比明显高于MM组),推测可能是由于PSMM组内部微孔隙的存在为血管的形成和迁移提供了更多的空间。
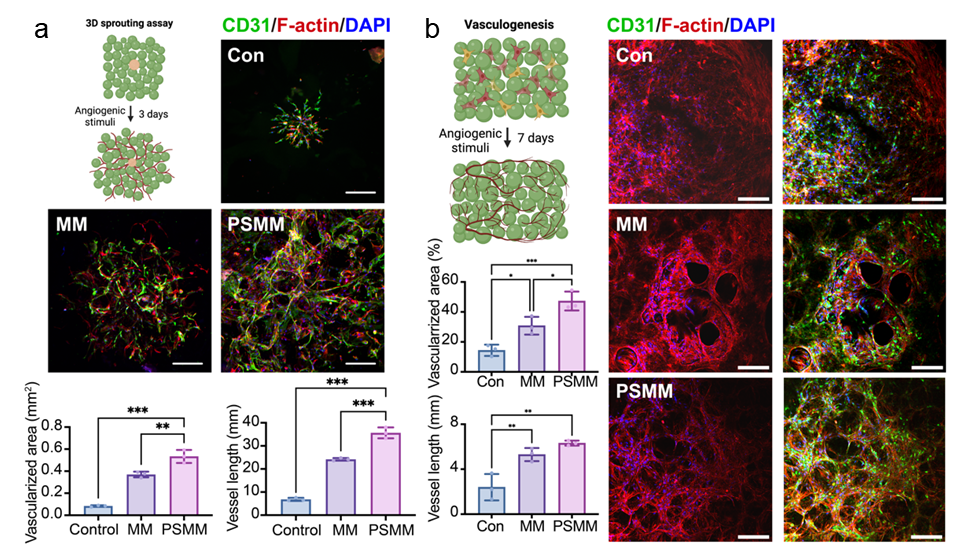
图2. PSMM支架促进体外血管化
最后,在缺血性卒中大鼠模型中,负载NPCs的PSMM-基质复合支架,显著提升了移植细胞的存活、增殖和神经元分化,促进了卒中核心区血管新生,减少了胶质瘢痕形成,并在28天后明显改善了神经功能恢复(图3)。
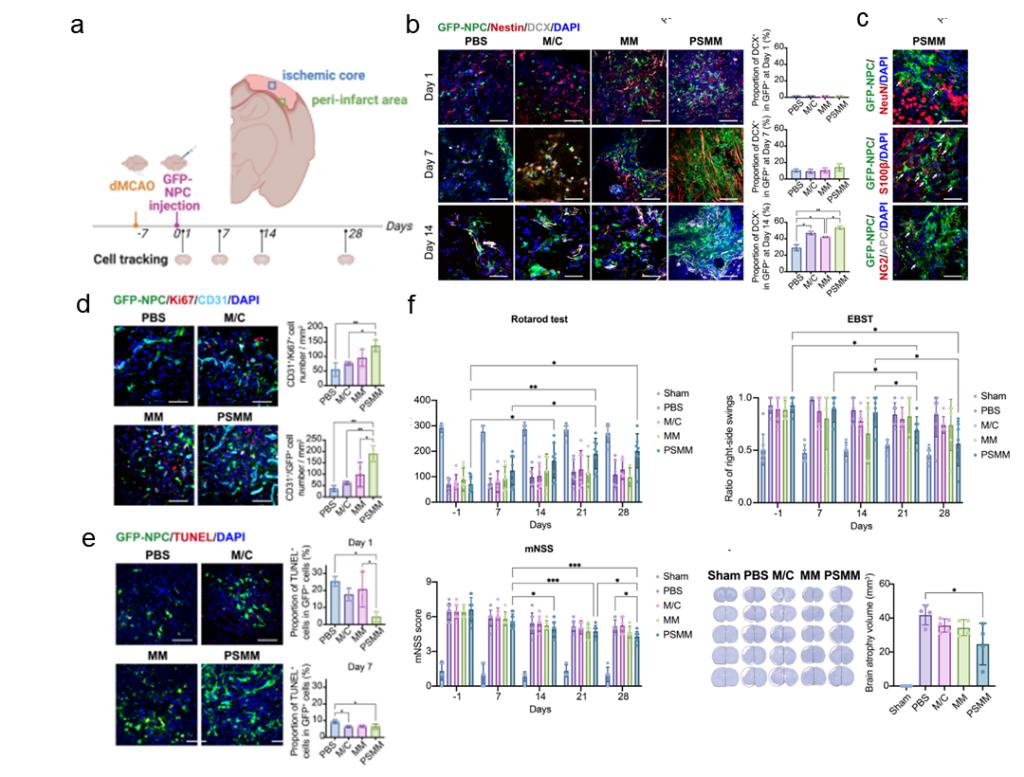
图3. 负载NPCs的PSMM-基质复合支架促进大鼠卒中后损伤修复
综上,该研究开发的PSMM-基质复合支架是一种极具潜力的干细胞封装平台,兼具高通量、高生物相容性和可注射性。其微孔结构与间质基质显著提升NPCs的递送效率以及移植后的存活,并促进神经—血管重建。该成果为卒中治疗中的干细胞递送难题提供了新的解决思路,也为神经退行性疾病的创新疗法奠定了坚实基础。
同济大学生命科学与技术学院博士研究生吴华艳、上海交通大学生物医学工程学院博士研究生刘泽、同济大学生命科学与技术学院硕士研究生张紫杰为论文共同第一作者,同济大学生命科学与技术学院王冕教授、高绍荣教授、上海交通大学李婉露助理教授为论文共同通讯作者。
论文链接:https://www.nature.com/articles/s41467-025-64240-1