同济大学毛志勇团队揭示细胞核内cGAS抑制LINE1逆转录转座的新功能,相关成果发表于《自然·通讯》
来源:生命科学与技术学院 时间:2023-12-12 浏览:
cGAS是重要的胞浆DNA识别受体,可结合胞内DNA后触发固有免疫反应,在病毒入侵、自身免疫疾病、衰老及肿瘤发生发展等多种生物学过程中发挥重要作用。值得注意的是,近些年来一些研究发现cGAS亦存在于细胞核中。然而,核内丰富的DNA极易导致cGAS过度激活,引发强烈的固有免疫反应。此外,课题组的前期合作研究还揭示核内cGAS可能抑制同源重组修复促进基因组不稳定。由此可见,cGAS在细胞核内存在诸多潜在的危害。那么,为何cGAS的核转位在长期演化中被保留下来?领域内科学家猜测cGAS在细胞核内可能还发挥着一些尚未被发现的与基因组稳定性相关的正面功能。与猜想一致,哈佛医学院兰利教授团队发现:核内cGAS可能充当DNA复制减速器维持基因组稳定性。而另一项研究也提示:核内cGAS还可抑制有丝分裂染色体末端融合从而稳定基因组。
LINE-1(Long Interspersed Nuclear Element 1, L1)是机体内唯一可以自主发生逆转录的转座子,其编码2个重要蛋白:ORF1p和ORF2p。其中,ORF2p具有核酸内切酶和逆转录酶活性,对L1的转座具有重要作用。一些研究指出,核酸内切酶ORF2p会诱发DNA损伤,进而加剧基因组不稳定,甚至引起衰老和肿瘤发生等严重后果。但由于其分子量较大、蛋白丰度相对较低且缺乏特异性抗体,围绕ORF2p调控开展的研究非常有限。作为DNA识别受体,有研究表明cGAS可以结合L1逆转录产生的cDNA,驱动I型干扰素等炎性因子分泌,诱导衰老发生。但从进化角度分析,cGAS的出现早于I型干扰素。由此,研究团队猜测:除介导固有免疫调控外,cGAS可能对L1还存在着其它层面的调控。
12月12日,同济大学生命科学与技术学院/附属妇产科医院毛志勇教授团队在《自然·通讯》(Nature Communications)杂志发表了题为“Nuclear cGAS restricts L1 retrotransposition by promoting TRIM41-mediated ORF2p ubiquitination and degradation”的研究论文,首次揭示核内cGAS可通过促进ORF2p降解进而抑制L1逆转录转座,维持基因组稳定性的全新正面功能。

在该项工作中,团队成员首先通过利用L1逆转录转座报告系统发现:cGAS可显著抑制L1逆转录转座效率。而分子机制研究提示:cGAS与L1编码的ORF2p存在蛋白间的相互作用,进而促进ORF2p通过泛素-蛋白酶体途径降解,最终抑制L1转座效率。考虑到cGAS并不是泛素化过程的关键酶,团队成员通过蛋白质谱分析筛选获得了5个与ORF2p存在相互作用的E3泛素连接酶。进一步实验表明:其中TRIM41这一E3泛素连接酶可以促进ORF2p的K48类型泛素化并介导其降解。值得注意的是,cGAS可以增强TRIM41与ORF2p之间的相互作用,以TRIM41依赖的方式促进ORF2p蛋白降解并抑制L1逆转录转座。进一步实验证实: cGAS与ORF2p的互作发生在细胞核内,而仅有核定位的cGAS具有抑制L1逆转录转座的功能。这提示抑制L1逆转录转座是cGAS的又一核内功能。
DNA损伤发生后,染色质的松散有利于DNA修复的高效进行;但另一方面,这也使ORF2p有更多机会接近染色质DNA,可能导致更多DNA损伤的产生。团队的进一步研究发现:在损伤发生后,损伤应答激酶CHK2可与cGAS发生互作,磷酸化cGAS的S120和S305位点,增强cGAS-TRIM41和TRIM41-ORF2p相互作用,进而介导ORF2p蛋白降解。这一发现揭示了DNA损伤应答与L1逆转录转座调控间存在着复杂而精细的串话。
领域内的一些研究表明:L1的转录活性在衰老过程中显著提升。但是,衰老细胞中L1的逆转录转座事件并未如预期般上调。这驱使团队成员进一步探索cGAS是否在细胞衰老过程中调控L1的逆转录转座。有趣的是,衰老细胞中DNA损伤积累伴随着CHK2的激活,导致核内cGAS的S120和S305位点的磷酸化水平提升,这可能进而激活TRIM41-ORF2p互作,引发对L1的逆转录转座的抑制。另一方面,通过TCGA数据库分析,团队成员还发现了37个cGAS的肿瘤相关突变体,而其中7个突变体通过影响CHK2-cGAS-TRIM41-ORF2p信号轴的不同过程,导致L1逆转录转座抑制能力的缺失。这一发现提示:cGAS对L1的调控功能可能有助于基因组稳定性的维持,进而防止细胞发生恶性转化。
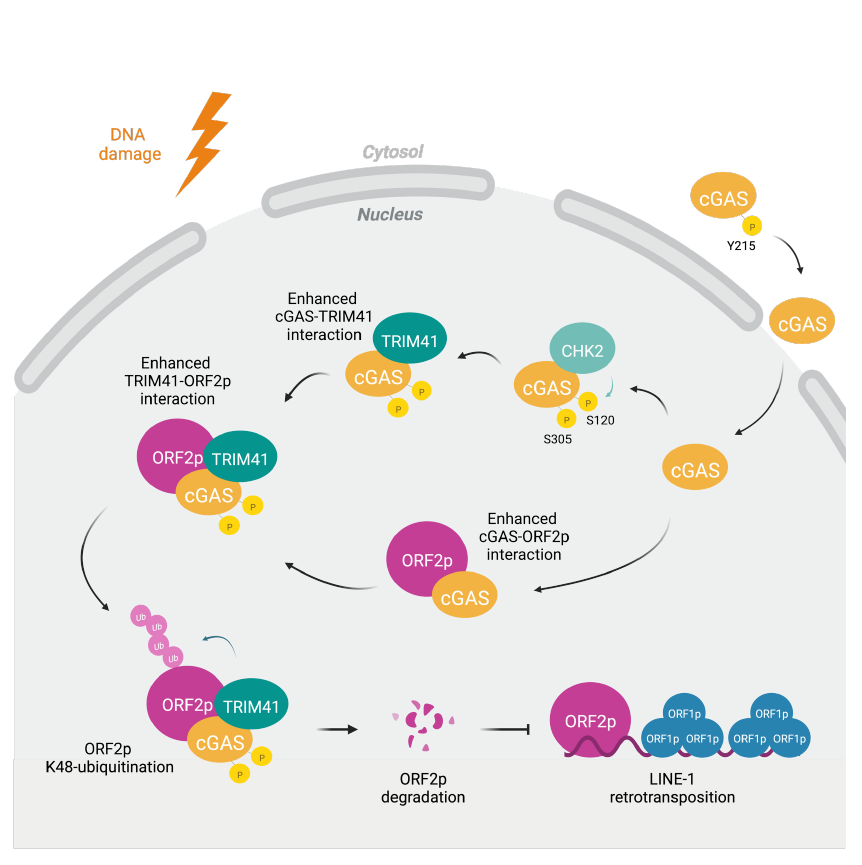
CHK2-cGAS-TRIM41轴介导ORF2p降解抑制L1逆转录转座
综上所述,该研究揭示了核内cGAS通过抑制L1逆转录转座而维持基因组稳定性的正面功能及其分子机制,也为发展靶向cGAS干预衰老及肿瘤发生的新方法奠定了基础。
同济大学生命科学与技术学院的博士研究生甄政毅和助理教授陈御为论文的共同第一作者。同济大学生命科学与技术学院/附属妇产科医院毛志勇教授为论文通讯作者。毛志勇团队王海燕、唐欢胤博士、张海萍助理研究员和蒋颖副教授也参与了该项工作。该研究工作还得到了同济大学附属上海市肺科医院刘海鹏教授的支持。该研究得到科技部、基金委和上海市科委项目的资助。
论文链接:https://www.nature.com/articles/s41467-023-43001-y