生命科学与技术学院汪世龙团队设计光敏NiFe-LDH多功能肿瘤协调治疗体系为宫颈癌免疫治疗提供新策略,成果发表于《化学工程期刊》
来源:生命科学与技术学院
时间:2026-01-13 浏览:
近日,同济大学生命科学与技术学院汪世龙教授课题组在《化学工程期刊》(Chemical Engineering Journal)上发表题为“Light-sensitive NiFe-layered double hydroxide as ferroptosis and autophagy agonists for cervical cancer immunotherapy”的研究论文。团队围绕宫颈癌局部精准治疗与免疫激活难题,构建基于光敏NiFe-LDH的多功能治疗体系,首次揭示其通过铁死亡、自噬及免疫调控协同作用抑制肿瘤生长的分子机制。

宫颈癌是全球女性中高发的恶性肿瘤之一,传统治疗方式在控制局部病灶的同时,往往伴随较大的系统毒性和生殖功能损伤风险。针对这一临床限制,团队巧妙利用宫颈癌局部解剖结构与肿瘤微环境特征,提出一种可通过局部给药与光照协同作用的多通路治疗策略,力求在提升治疗效率的同时降低全身不良反应。研究团队采用简便可控的方法制备了NiFe-LDH体系,该体系在酸性肿瘤微环境中可逐步释放活性金属离子,显著增强细胞内活性氧水平。研究发现,该体系本身即可在肿瘤环境中发挥显著的细胞杀伤作用;在可控蓝光激发下,其活性进一步增强,形成放大的氧化应激效应。进一步研究证实,该体系通过抑制PI3K/AKT/mTOR信号轴,表现出类似雷帕霉素的mTOR抑制效应,从而促进自噬过程;同时通过下调xCT和GPX4等关键分子,破坏细胞抗氧化防御体系,诱导铁依赖性脂质过氧化。通过小分子抑制剂和激动剂进一步验证,两种细胞死亡方式并非孤立发生,而是通过mTOR信号节点形成协同调控网络。此外,NiFe-LDH不仅直接作用于肿瘤细胞,还能够重塑肿瘤免疫微环境,治疗后肿瘤组织中CD4⁺ T细胞、CD8⁺ T细胞、成熟树突状细胞及自然杀伤细胞比例显著升高,提示该体系兼具免疫佐剂功能,可同步激活特异性与非特异性抗肿瘤免疫反应。
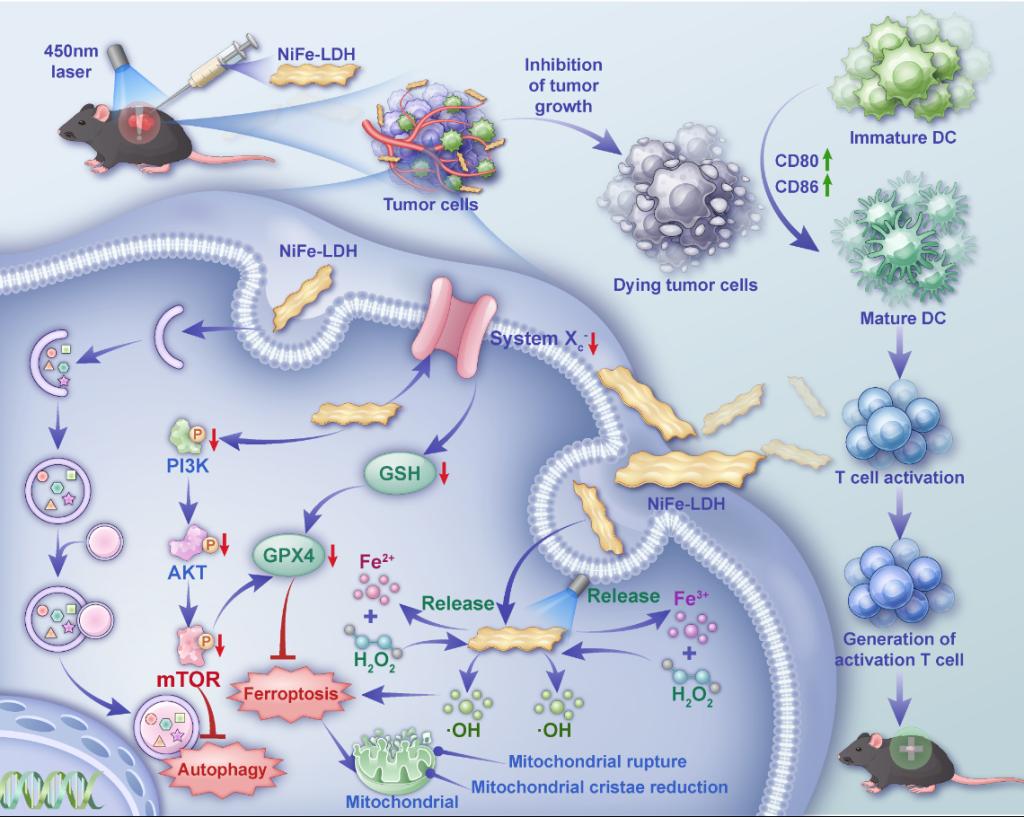
光敏NiFe-LDH通过产生活性氧、诱导铁死亡及自噬来抑制肿瘤生长并激活肿瘤免疫的TC-1细胞功能机制示意图
与传统依赖药物负载的治疗体系不同,该研究所构建的NiFe-LDH无需引入额外化疗药物或光敏分子,体现出“结构本身即具备治疗功能”的设计理念,显著降低了体系复杂性和潜在安全风险。这种集活性氧放大、铁死亡诱导、自噬激活与免疫调控于一体的综合治疗策略,为宫颈癌治疗提供了新的方法和理论支持。其制备工艺简便、成本可控、适合局部给药的特点,也为后续临床转化奠定了良好基础。
同济大学生命科学与技术学院和附属东方医院医学科学与技术创新中心汪世龙教授,附属同济医院康复医学中心沈玉芹主任和生命科学与技术学院助理教授静国欣为论文共同通讯作者。同济大学生命科学与技术学院博士研究生高艺为论文第一作者,课题组博士后王虹等人也参与了研究工作。该研究得到了国家自然科学基金和上海市启明星培育等项目的资助。
论文链接:https://doi.org/10.1016/j.cej.2025.172339