生命科学与技术学院祝颖慧团队揭示急性髓系白血病新发病机制及治疗新靶点,成果发表于《临床研究杂志》
来源:生命科学与技术学院
时间:2025-06-04 浏览:
急性髓系白血病(AML)是一种起源于造血干/祖细胞的高度异质性恶性血液肿瘤,具有发病率高、死亡率高、治疗难度大等特点。尽管传统的联合化疗在一定程度上能够缓解病情,但长期生存率仍未显著改善,尤其在老年患者中疗效更为有限,5年生存率不足10%。近年来,随着靶向药物和免疫治疗的不断推进,部分AML患者开始从个体化治疗中获益。然而,AML仍缺乏理想的治疗靶点,尤其是兼具髓系特异性且不影响正常造血功能的抗原,限制了其在免疫和细胞治疗方面的进一步突破。
CD84是信号淋巴细胞激活分子(SLAM)家族成员之一,广泛参与T细胞活化、自噬、细胞因子分泌等免疫过程,已有研究表明,CD84在慢性淋巴细胞白血病和多发性骨髓瘤中发挥重要免疫调控作用。然而,尽管CD84在多种免疫细胞中功能活跃,其在AML中的表达特征、功能及作用机制尚不明确,亟待进一步研究。
近日,同济大学生命科学与技术学院祝颖慧团队和美国City of Hope医疗中心Flavia Pichiorri团队在《临床研究杂志》(The Journal of Clinical Investigation)上发表了题为“Identification of CD84 as a potent survival factor in acute myeloid leukemia”的研究论文。该研究首次明确CD84是AML中特异性高表达的膜表面分子靶点,并揭示其作为AML关键生存调控因子的重要作用。敲降CD84可显著抑制AML细胞增殖,延长异种移植小鼠的生存期,机制上,CD84通过维持AML细胞的线粒体功能和抗氧化防御,促进其生存与疾病进展。该研究揭示了一种新型细胞表面分子调控AML发生发展的功能和作用机制,同时为AML治疗提供新靶点和新思路。目前,相关免疫治疗的临床转化研究正在推进中。

为系统解析CD84的表达特征,研究团队整合公共数据库并结合质谱流式等技术,发现CD84在早期髓系祖细胞及其分化谱系中高表达,而在正常造血干/祖细胞中表达较低。多个AML队列分析显示,CD84在AML骨髓/外周血样本及细胞系中显著上调,且其高表达与不良预后密切相关。进一步分析表明,CD84在各AML亚型中普遍高表达,主要集中于原始细胞群,而在正常组织中表达有限,提示CD84作为AML潜在治疗靶点具有选择性和特异性。
进一步功能研究,在AML细胞系及原代病人细胞中敲降CD84可显著抑制AML细胞的增殖和克隆形成,并诱导细胞凋亡。进一步结合细胞系来源及患者来源异种移植模型,以及MLL-AF9和inv(16) AML小鼠模型,证实CD84缺失可显著减弱AML的体内移植能力,延长小鼠生存周期;相反,过表达CD84促进AML进展,该效应可通过CD84敲降逆转。
在机制研究中,研究者发现CD84敲降重塑AML细胞的代谢平衡并诱导线粒体应激。RNA-seq分析显示,CD84的缺失抑制多条能量代谢通路。功能实验证实,CD84敲降显著降低AML细胞氧耗率、糖酵解及脂肪酸氧化能力,并引起线粒体形态紊乱、膜电位丧失及功能障碍;这些损伤可通过CD84的重新表达得到部分恢复。进一步研究发现,CD84敲降抑制谷胱甘肽合成,削弱抗氧化防御能力,增强ROS积累,提示其通过维持氧化还原稳态中的重要作用。此外,CD84有助于维持转录因子NRF2的蛋白稳定性及核转位,促进抗氧化响应元件的转录活性,而其敲降则增强NRF2与其抑制蛋白KEAP1的结合,促进NRF2泛素化降解,抑制抗氧化转录程序。综上,CD84通过调控能量代谢、维持线粒体稳态及抗氧化系统,在AML细胞中发挥的生存调控作用。
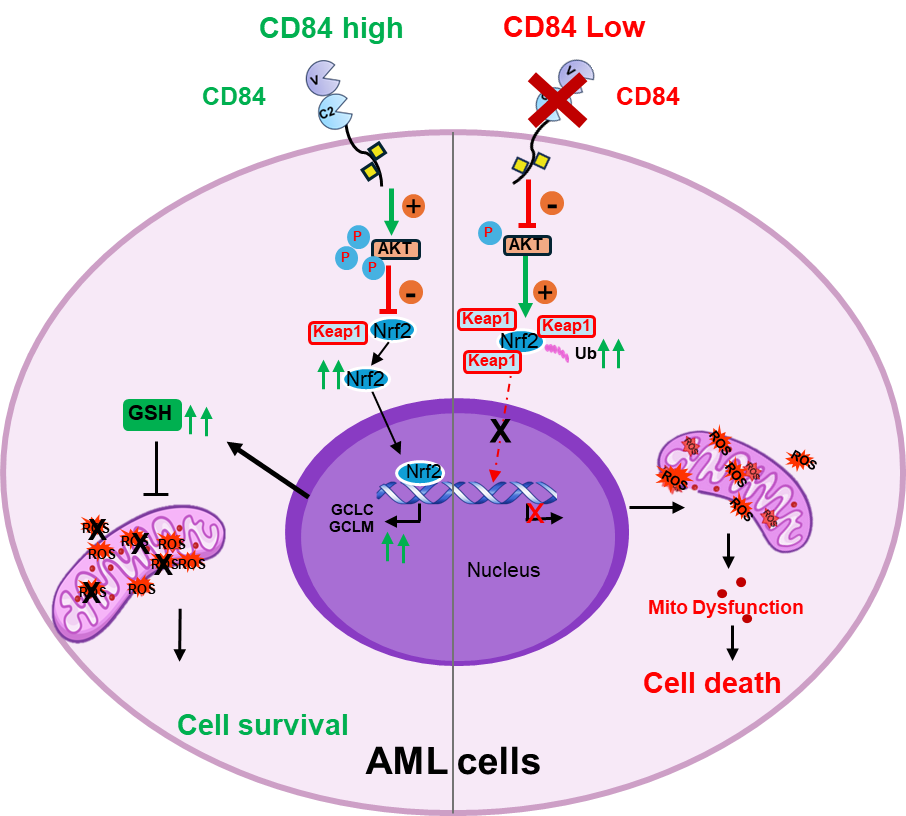
该研究明确了CD84通过调控线粒体功能和NRF2介导的抗氧化通路促进AML进展的机制,并结合多种体内外模型证实了其具备作为AML治疗靶点的潜力,为开发新型AML免疫治疗策略提供了新的分子基础和临床转化依据。
祝颖慧研究员和Flavia Pichiorri教授为论文共同通讯作者,祝颖慧研究员、City of Hope医疗中心Mariam Murtadha博士和同济大学刘苗苗博士研究生为论文共同第一作者。该研究得到了国家自然科学基金委、科技部重点研发计划以及教育部细胞干性与命运编辑前沿科学中心的支持。
论文链接:https://www.jci.org/articles/view/176818